
Oxidante
De Wikipedia, la enciclopedia libre

Símbolo de riesgo químico de la Unión Europea para agentes oxidantes

Etiqueta genérica de mercancías peligrosas para agentes oxidantes
Un oxidante es un compuesto químico que oxida a otra sustancia en reacciones electroquímicas o redox. En estas reacciones, el compuesto oxidante se reduce.
Básicamente:
- El oxidante se reduce
- El reductor se oxida
- Todos los componentes de la reacción tienen un número de oxidación
- En estas reacciones se da un intercambio de electrones
Tabla de contenidos |
[editar] Ejemplo de reacción redox
La formación del óxido de hierro es una clásica reacción redox:
- 4 Fe(s) + 3 O2(g)
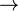 2 Fe2O3(s)
2 Fe2O3(s)
En la ecuación anterior, el hierro (Fe) tiene un número de oxidación 0 y al finalizar la reacción su número de oxidación es +3. El oxígeno empieza con un número de oxidación 0 y al final su número de oxidación es de -2. Las reacciones anteriores pueden entenderse como dos semirreacciones simultáneas:
- Semirreacción de oxidación: 4 Fe(s)
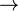 2 Fe2O3(s) + 12 e–
2 Fe2O3(s) + 12 e– - Semirreacción de reducción: 3 O2(g) + 12 e–
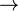 2 Fe2O3(s)
2 Fe2O3(s)
El hierro (III) se ha oxidado debido a que su número de oxidación se ha incrementado y actúa como agente reductor, transfiriéndole electrones al oxígeno, el cual disminuye su número de oxidación (se reduce) aceptando los electrones del hierro.
[editar] Significados alternativos
Debido a que la reacción de oxidación está tan extendida (explosivos, síntesis química, corrosión), el término oxidante ha pasado a adquirir múltiples significados.
En una definición, el oxidante recibe electrones de un reactivo. En este contexto, el oxidante se denomina aceptor de electrones. Un oxidante clásico es el ion ferrocenio [Fe(C5H5)2]+, el cual puede aceptar un electrón y transformarse en ferroceno Fe(C5H5)2. El mecanismo de transferencia electrónica es de gran interés, y puede ser descrito como de esfera interna o externa.
En otra acepción más coloquial, el oxidante transfiere átomos de oxígeno al sustrato. En este contexto, el oxidante puede ser descrito como un agente oxigenante o un agente de transferencia de átomos de oxígeno. Algunos ejemplos son el anión permanganato MnO4–, el cromato CrO4– y el tetróxido de osmio, OsO4. Nótese que todos estos compuestos son óxidos, más concretamente polióxidos. En algunos casos, estos óxidos pueden utilizarse como aceptores de electrones, como en la reacción de conversión de permanganato MnO4– a manganato MnO42-.
[editar] Oxidantes comunes
- Hipoclorito y otros hipohalitos como las lejías.
- Iodo y otros halógenos.
- Clorito, clorato, perclorato y compuestos halógenos análogos.
- Sales de permanganato, como el permanganato de potasio.
- Compuestos relacionados con el Cerio (IV).
- Compuestos cromados hexavalentes, como el ácido crómico, el ácido dicrómico y el trióxido de cromo, clorocromato de piridinio (PCC) y cromatos/dicromatos.
- Peróxidos, como el peróxido de hidrógeno (H2O2) o agua oxigenada.
- Reactivo de Tollens
- Sulfóxidos
- Ácido persulfúrico
- Ozono
- Tetróxido de osmio OsO4
[editar] Agentes oxidantes y sus productos de oxidación
| Agente | Producto |
|---|---|
| O2 oxígeno | Varios, incluyendo óxidos, H2O, ó CO2 |
| O3 ozono | Varios, incluyendo cetonas y aldehídos, ver ozonólisis |
| F2 flúor | F? |
| Cl2 cloro | Cl? |
| Br2 bromo | Br? |
| I2 iodo | I? |
| ClO? hipoclorito | Cl? |
| ClO3? clorato | Cl? |
| HNO3 ácido nítrico | NO óxido nítrico, NO2 dióxido de nitrógeno |
| Cromo hexavalente | Cr3+ |
| MnO4? permanganato | Mn2+ (ácido) or MnO2 (básico) |
| H2O2, otros peróxidos | Varios, incluyendo óxidos como el H2O |
Existen muchísimos más oxidantes.
[editar] Véase también
