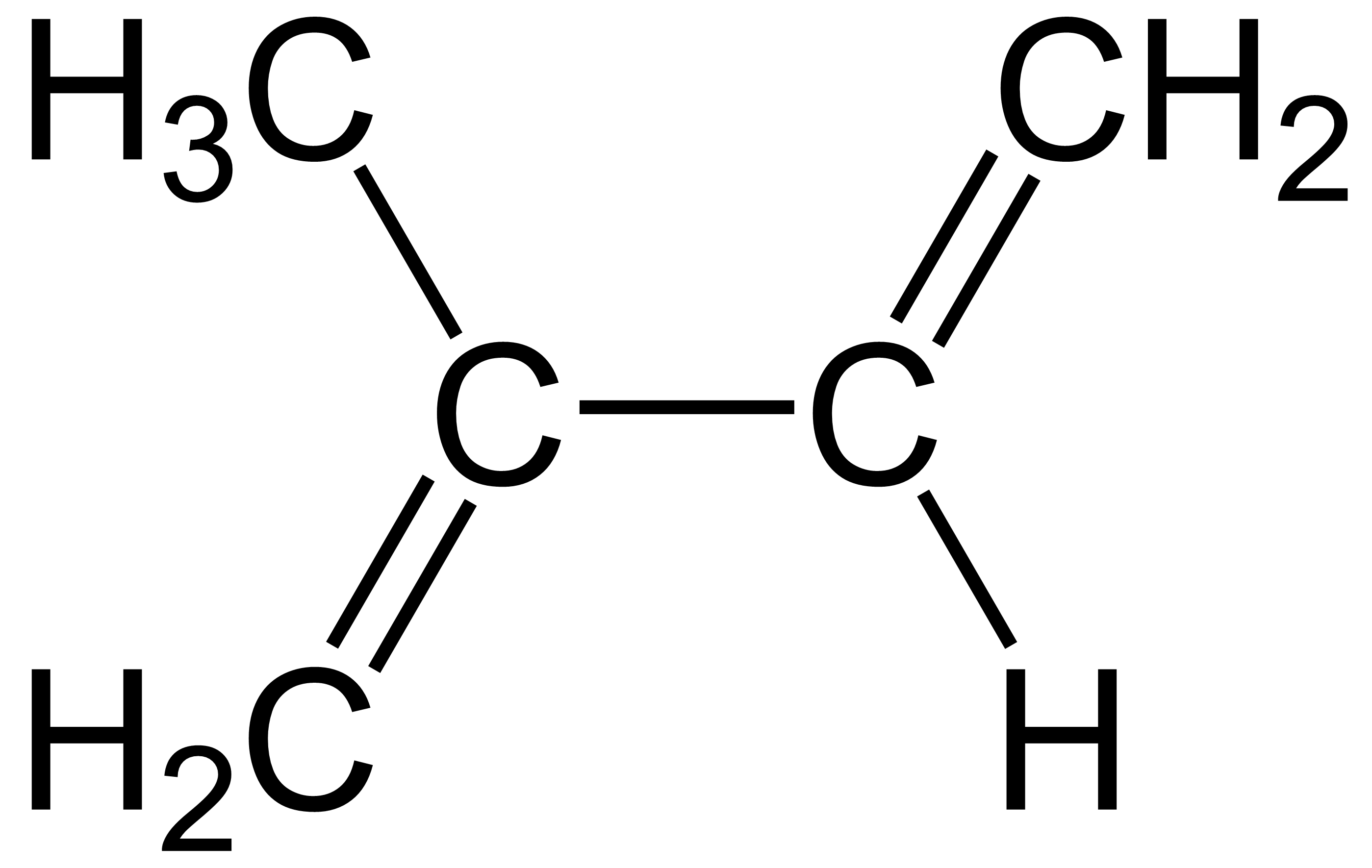
Isopreno
De Wikipedia, la enciclopedia libre
| Isoprene | |
|---|---|
| Nombre químico | 2-Metill-1,3-butadieno |
| Otros nombres | Isopreno |
| Fórmula química | C5H8 |
| Masa molecular | 68,11 g/mol |
| Número CAS | [78-79-5] |
| Densidad | 0,681 g/cm³ |
| Punto de fusión | -145,95 °C |
| Punto de ebullición | 34,067 °C |
| SMILES | C=C(C)C=C |
| Disclaimer and references | |
Isopreno es el sinónimo de la fórmula química 2-metilbuta-1,3-dieno. Se emplea frecuentemente en la industria y en grandes cantidades se trata de un contaminante y tóxico que puede hacer daño al medio ambiente. A temperatura ambiente el isopreno es un líquido incoloro altamente inflamable y de fácil ignición. En contacto con el aire es altamente reactivo, capaz de polimerizarse de forma explosiva si se calienta. En algunos paises como Estados Unidos el departamento de transporte considera el isopreno un material peligroso que necesita de marcas especiales.
[editar] Roles Biológicos y Efectos
El isopreno se elabora de forma natural en los animales y en las plantas y es generalmente el hidruro más encontrado en el cuerpo humano. La producción estimada de isopreno en el cuerpo humano es de 15 µmol/kg/h, equivalente aproximadamente a 17 mg/día para una persona de 70 kg. El Isopreno es conocido también en bajas concentraciones en algunos alimentos. El isopreno se produce en algunos cloroplastos de las hojas de ciertos árboles mediante el ciclo DMAPP; la enzima que hace la síntesis del isopreno es responsable de su biosíntesis. La cantidad de isopreno generada por una planta depende la masa vegetal de las hojas, su área y la luz recibida, así como la temperatura. Durante la noche existe una pequeña emisión de isopreno mientras que por el día las emisiones pueden llegar a ser sustanciales durante el mediodía (~5-20 mg/m2/h).
[editar] Referencias
- Merck Index, Eleventh Edition, ISBN 911910-28-X ISBN 911910-28-X.
- Poisson, N., M. Kanakidou, and P. J. Crutzen, “Impact of nonmethanehydrocarbons on tropospheric chemistry and the oxidizing power of the global troposphere: 3-dimensional modelling results,” Journal of Atmospheric Chemistry, vol. 36, pp. 157?230, 2000.
- Monson, R. K., and E. A. Holland, “Biospheric trace gas fluxes and their control over tropospheric chemistry,” Annual Review of Ecological Systems, vol. 32, pp. 547?+, 2001.
- Claeys, M., B. Graham, G. Vas, W. Wang, R. Vermeylen, V. Pashynska, J. Cafmeyer, P. Guyon, M. O. Andreae, P. Artaxo, and W. Maenhaut, “Formation of secondary organic aerosols through photooxidation of isoprene,” Science, vol. 303, pp. 1173?1176, 2004.
- Pier, P. A., and C. McDuffie, “Seasonal isoprene emission rates and model comparisons using whole-tree emissions from white oak,” Journal of Geophysical Research, vol. 102, pp. 23,963?23,971, 1997.
- Poschl, U., R. von Kuhlmann, N. Poisson, and P. J. Crutzen, “Development and intercomparison of condensed isoprene oxidation mechanisms for global atmospheric modeling,” Journal of Atmospheric Chemistry, vol. 37, pp. 29?52, 2000.
- Guenther, A., T. Karl, P. Harley, C. Wiedinmyer, P. I. Palmer and C. Geron, “Estimates of global terrestrial isoprene emissions using MEGAN (Model of Emissions of Gases and Aerosols from Nature)”, Atmos. Chem. Phys., 6, 3181-3210, 2006. http://www.copernicus.org/EGU/acp/acp/6/3181/acp-6-3181.htm
[editar] Enlaces externos
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del isopreno.
- Flow Chart Showing the Biosynthesis of Isoprenes
- Report on Carcinogens, Eleventh Edition; U.S. Department of Health and Human Services, Public Health Service, National Toxicology Program